항체
덤프버전 :
분류

항원과 항체의 모식도이다. 항체의 연한 회색 부분은 경쇄(Light Chain)이고, 진한 회색 부분은 중쇄(Heavy Chain)이다.
1. 개요[편집]
항체(抗體, antibody; 줄여서 Ab)는 항원(抗原, antigen; 줄여서 Ag)의 자극에 의하여 생체 내에 만들어져 특이하게 항원과 결합하는 단백질이다. 면역계가 갖고 있는 무기 중 하나라고 할 수 있다. 항원에 특이적으로 달라 붙어[1] 항원을 둔화시키거나 침강시켜 대식세포가 쉽게 잡아먹을 수 있게 하기 때문. 이것을 '옵소닌화(Opsonization)'라고 한다. 또한, 보체(Complement)의 활성화 과정에도 깊게 관여한다. 면역글로불린(immunoglobulin)은 막결합부위(membrane binding region)가 있어 막결합부위 없이 혈액 안을 돌아다니는 항체와는 구조적, 기능적으로 조금 차이가 있지만, 임상에서는 둘을 크게 구분하지 않는다.
2. 발견[편집]
'항체'라는 용어가 처음 사용된 것은 독일의 과학자 파울 에를리히(Paul Ehrlich)의 논문에서 쓰인 'Antikörper'이지만, 항체라는 물질이 혈청에 존재한다는 획기적인 사실이 처음 알려진 것은 1890년에 이루어진 에밀 아돌프 폰 베링(Emil Adolf von Behring)과 키타사토 시바사부로(Shibasaburo Kitasato)의 연구이다. 이 두 과학자는 파상풍균을 이용한 실험에서 독성이 약화된 파상풍균에 걸린 적 있는 토끼의 혈청을 주사받은 마우스들은 이후 독성이 약화되지 않은 생독성 파상풍균에 감염되어도 멀쩡하다는 사실을 발견했다. 이 발견으로 베링은 1901년에 첫 노벨생리의학상을 수상하는 영예를 누렸다. 이 발견이 매우 중요했던 것은 두 가지 측면에서 설명할 수 있다. 첫째로는, 병원체에 감염된 생물은 혈청에 그 병원체를 막을 수 있는 물질을 생산한다는 점이다. 둘째는, 그렇게 형성된 물질은 혈청을 통해 다른 개체에게 전달될 수 있다는 점이다. 이런 발견은 오늘날 수많은 인명을 구했고, 또 구하고 있는 예방접종 개념의 기초가 되었다는 점에서 매우 중요하다.
3. 구조[편집]
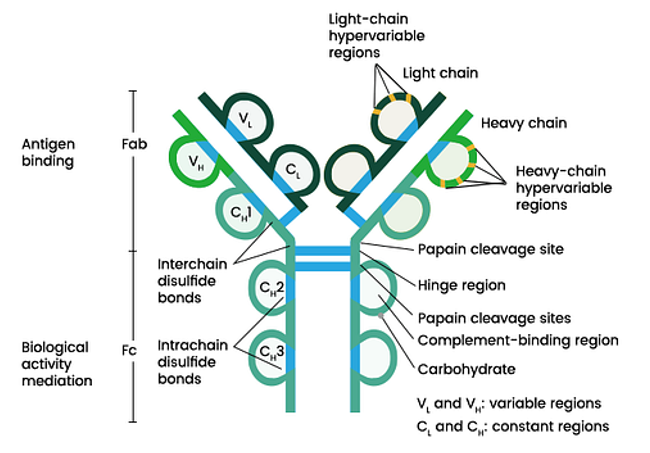
흔히 책에서는 Y 모양으로 그린다. 가변 영역(Variable region)과 불변 영역(Constant region)이 있는데, 가변 영역은 항원에 결합하고 불변 영역은 항체의 동형상(isotype)을 결정하는 데 쓰인다. 그리고 중쇄(heavy chain)와 경쇄(light chain)로도 구분하는데, 중쇄는 가변 영역과 불변 영역에 존재하고, 경쇄는 가변 영역에만 존재한다.
항체는 흔히 혈액 안을 이동하는 단백질을 총칭하는데, 막결합부위가 존재하여 B 세포와 같은 세포의 세포막에 결합해 있는 경우에는 막 면역글로불린(membrane immunoglobulin, mIg)이라고 불린다. 이 면역글로불린은 막결합부위 존재 여부만이 다르며 다른 구조나 항원 특이성은 항체와 거의 동일하다. 막결합부위가 만들어질지 아닐지는 면역글로불린 중쇄 불변부위를 암호화하는 mRNA에 따라 결정된다. 가령, 막결합 mRNA는 소수성인 세포막에 박혀 있는 수용체를 생산하여야 하므로 소수성 C 말단을 가지는 수용체를 생산하는 mRNA이고, 분비형 mRNA는 혈중을 돌아다니는 분비성 항체를 생산하여야 하므로 친수성 C 말단을 가지는 수용체를 생산한다. 이 mRNA는 항원에 의한 B 세포 활성화 여부에 따라 다르게 생성된다. 가령, 항원이 없어 B 세포가 비활성화된 상태일 때는 막 결합 형태의 B 세포 수용체(B cell receptor, BCR)를 생산하는 mRNA만을 전사한다. 그러나 항원이 들어와 B 세포가 항원을 제시받고 활성화된다면 B 세포는 막 결합 형태의 BCR과 분비형 항체를 생산하는 두 종류의 mRNA를 모두 전사한다.
3.1. 항체 구조의 발견[편집]
항체 구조가 4개의 폴리펩타이드 사슬(2개의 경쇄와 2개의 중쇄)로 이루어져 있다는 사실은 단백질 분해 효소인 파파인(papain)[2]과 펩신(pepsin), 이황 결합을 분해하는 베타 머캅토에탄올(β-mercaptoethanol)을 이용한 실험을 통해 밝혀졌다. 이 실험은 재밌게도 미국과 영국에서 거의 동시에 독립적으로 이루어졌고, 이 실험을 통해 항체 구조 해명의 공로를 인정받은 미국의 과학자 제럴드 모리스 에덜먼(Edelman, G. M.)과 영국의 과학자 로드니 로버트 포터(Porter, R. R.)는 1972년에 노벨생리의학상을 수상하였다.
대략적인 실험 과정은 이하와 같다. 위 그림은 실험에 이용된 물질들이 항체 구조에 가져오는 변화를 나타낸 모식도이다. 실험 이전, 알려져 있던 사전 정보는 면역글로불린 G(IgG)의 분자량은 대략 150,000Da(Dalton, 달튼)이라는 것이었다.
먼저, 파파인을 이용하여 IgG를 절단한다. 이때 형성된 절편은 총 3개였으며, 2개의 절편만이 동일한 구조를 가지고 있음이 확인되었다. 분자량은 셋 모두가 약 50,000Da으로 대동소이했다. 이때 혼자만 달랐던 절편은 현재는 작동 부위(effector region)이라고 불리기도 하는, Fc 절편(fragment crystalizable, 결정화절편)이다. 한편, 2개의 구조가 같은 절편은 서로가 서로의 항원 결합의 경쟁적 저해제로 작용하였는데, 이를 통해 연구자들은 이 두 절편에 항원 결합 부위가 존재함을 알 수 있었다. 이 두 절편은 항원이 결합하므로 Fab 절편(fragment antigen binding)으로 명명되었다.
한편, 펩신을 이용한 절단 실험에서는 하나의 절편만이 형성되었다. 이 절편은 항원결합부위 2개를 가졌으며 분자량은 대략 100,000Da였다. 위의 파파인을 이용한 절단 경우와 비교하여 생각해 보면 이 100,000Da 절편은 위 파파인 실험에서 형성된 구조가 같은 두 절편이 결합되어 있는 F(ab')2 절편[3]이라고 생각할 수 있다. Fc 절편은 이 펩신 처리 시에는 잘게 분해되어 확인하는 것이 불가능하다.
마지막으로, 베타 머캅토에탄올로 이황 결합이 분리되어 환원된 항체 실험의 경우, 2개의 50,000Da 절편과 2개의 22,000Da 절편이 형성되었다. 이미 답을 알고 있는 입장에서 보면 당연히 전자가 중쇄, 후자가 경쇄이다.
이 실험 결과들을 종합하여 항체의 구조를 제시하는 데에는 Fab 절편과 Fc 절편에 대응하는 항체가 이용되었다. IgG의 절편에 결합하는 항체들이 중쇄나 경쇄에 결합하는지 여부를 통해 중쇄와 경쇄가 어느 부위를 이루는지를 알아내기 위해서이다. 그 결과, 항 Fab 항체는 중쇄와 경쇄에 모두 결합하였지만, 항 Fc 항체는 중쇄에만 결합하였다. 따라서, 파파인 실험에서 얻어냈던 50,000Da짜리의 Fc 절편은 모두 중쇄로만 이루어져 있다. 중쇄와 경쇄의 N 말단은 Fab 절편에 존재한다는 것이 다른 방법으로 밝혀진 상태였으므로, 이 결과들을 종합하여 '항체는 4개의 사슬로 이루어져 있으며, 항원에 결합하는 부위는 중쇄와 경쇄의 N 말단이 쌍을 이뤄 형성한다'라는 사실을 발견할 수 있었다.
3.2. 중쇄와 경쇄[편집]
항체 단량체(monomer)는 2개의 동일한 중쇄와 2개의 동일한 경쇄로 이루어진다. 중쇄가 경쇄보다 분자량이 큰(=무거운) 폴리펩타이드 사슬이다. 2개의 중쇄끼리, 또 경쇄와 이웃하는 중쇄끼리는 시스테인 잔기(cysteine residue)끼리의 이황 결합(disulfide bond)을 통해 결합한다. 폴리펩타이드 사슬의 N 말단(N terminus, 아미노기 말단) 부위는 변이가 많아서 가변 부위(variable region, V region)라고 부르며, 사슬의 C 말단(C terminus, 카복실기 말단) 부위는 변이의 경우가 한정되어 있어 불변 부위(constant region, C region)라고 부른다.
경쇄는 2개의 면역글로불린 도메인으로 구성되어 있으며, 항원 결합 부위 쪽에는 경쇄 가변 부위(VL)가 있고 작동 부위 쪽에는 경쇄 불변 부위(CL)가 있다. 경쇄는 불변 부위의 종류에 따라 두 종류로 나뉘며, 경쇄 쇄형에는 κ(kappa, 카파)와 λ(lambda, 람다)가 존재한다. 람다 경쇄는 4개의 하위 클래스(λ1~λ4)로 분류되며 λ1 경쇄가 람다 경쇄 중 가장 흔하다.
중쇄는 보통 4개 또는 5개(위 그림에서는 4개)의 면역글로불린 도메인으로 구성되어 있으며, 항원 결합 부위의 도메인은 중쇄 가변 부위(VH)이다. 그 외의 항원 결합 부위를 이루지 않는 도메인들은 중쇄 불변 부위(CH)이다. 중쇄 불변 부위는 여러 개이므로 CH1, CH2, CH3과 같이 표기한다. 중쇄 불변 부위에는 μ(mu, 뮤), δ(delta, 델타), γ(gamma, 감마), α(alpha, 알파), ε(epsilon, 엡실론), 총 5개의 주요한 쇄형이 존재하며, 이 중쇄 불변 부위 쇄형은 항체의 동형(isotype)을 결정한다. 감마 중쇄는 람다 경쇄처럼 4개의 하위 클래스(γ1~γ4)로 나뉘며 γ1 클래스 중쇄가 감마 중쇄 중 가장 흔하다.
3.3. 항원 결합 부위[편집]
항원 결합 부위(antigen binding site, paratope)는 Y자 모양 항체에서 양 끝점 2개로, 경쇄와 중쇄의 가변 부위로 이루어져 있다. 각 항원 결합 부위에는 6개의 고변이 영역이 존재한다. 항체의 항원 결합 부위는 항원의 항체결합부위, 또는 항원결정기(epitope)와 결합한다.
3.3.1. 고변이 영역[편집]
항원 결합 부위의 경쇄 가변 부위와 중쇄 가변 부위에는 각각 3개의 고변이 영역(hypervariable region)이 존재한다. 이 3개의 영역들은 고리 모양을 하고 있으며 항원과 직접적으로 결합하는 부위이다. 고변이 영역은 항원과 상보적으로 결합하여 어떤 항원이 붙을지를 결정하기 때문에 상보성 결정 부위(complementary determining region, CDR)이라고도 불린다. 이 부위는 V(D)J 재조합(V(D)J recombination)에 의해서 항체 다양성이 발생하는 가장 주된 부위이며, CDR의 존재는 항체의 다른 부위들이 크게 변하지 않고서도 항체 다양성을 크게 늘리는 데에 기여하여 항체 분자가 구조적으로 유지될 수 있도록 한다. 3개의 상보성 결정 부위는 각각 CDR1, CDR2, CDR3로 표기한다. 이 중 CDR3에서 변이가 가장 많이 일어난다고 알려져 있다. 이 상보성 결정 부위들에 돌연변이가 자주 일어나는 주된 이유는 이 부위들을 생성하는 염기서열이 체세포 과돌연변이(somatic hypermutation, SHM)를 일으키는 AID(activation-induced cytidine deaminase, 활성화 유도 시티딘 탈아민효소)의 표적이 되기 쉬운 돌연변이 핫 스팟(mutational hot spot)이기 때문이다.
3.4. 경첩 영역[편집]
경첩 영역(hinge region)은 감마, 델타, 알파 클래스의 중쇄에만 존재하는 프롤린이 풍부한 영역으로, 항원-항체 결합력을 높인다. 뮤와 엡실론 클래스 중쇄에는 경첩 영역이 존재하지 않는다. 이 두 중쇄 클래스에는 Ig 도메인이 4개가 아닌 5개가 존재한다.
3.5. 작동기 영역[편집]
작동기 영역(effector region)은 항체가 포식작용이나 보체활성화의 고전경로 등을 개시시키는 등의 기능을 하도록 하는 중쇄로만 이루어진 영역으로, 위에서 나온 Fc 절편 부분이라고 볼 수 있다. 백혈구 등에 존재하는 Fc 수용체(Fc receptor, FcR)는 이 부분에 결합하여 동형마다 상이한 항체 기능들을 활성화시킨다. B 세포 막에 결합한 상태인 BCR의 중쇄는 세포 내로 이어지는 짧은 꼬리 부분(cytoplasmic tail)을 가진다.
4. 기능[편집]
밑에서 서술하는 동형에 따라서 상세한 기능들이 다르지만, 항체들이 수행하는 기능들은 다음과 같다.
- 중화(neutrilazation) - 병원체나 병원체가 분비하는 독소가 세포 내로 세포내이입(endocytosis)되는 것을 방지하며, 모든 클래스의 항체들이 가지는 기능이다.
- 응집(agglutination) - 단량체 항체는 2개의 항원 결합 부위를 가지므로, 항체는 여러 병원체에 동시에 결합하여 병원체들이 서로 뭉치게 하여 중화 작용이나 물리적인 제거가 쉽게 일어날 수 있게 하는데, 이를 응집 작용이라고 한다.
- 옵소닌화(opsonization) - 포식세포의 포식능을 강화시키는 작용이다. 항원 결합 부위가 항원에 결합하고 밑쪽의 Fc 부위는 포식세포 세포막의 수용체인 FcR에 결합하여 포식작용이 일어나기 쉽게 하며, 이런 식으로 일어나는 비정상 세포가 포식되는 포식작용은 항체의존성 세포포식작용(antibody-dependent cellular phagocytosis, ADCP)이라고 부른다.
- 보체의 활성화(complement activation) - 항원-항체 복합체(Ag-Ab complex; immune complex)는 보체 활성화가 일어나는 세 가지의 경로[4] 중 보체활성화 고전경로가 일어나도록 한다. 고전경로가 활성화되어 보체의 기능이 활성화되면 막공격복합체(membrane attack complex, MAC)가 형성되어 병원체 세포막을 뚫고 용균(lysis)을 일으킨다.
- 항체의존성 세포매개독성(antibody-dependent cell-mediated cytoxicity, ADCC) - 항체가 비정상 세포가 세포막에 발현하는 외부(non-self) 항원에 결합하면, 그 항체(특히 사람에서는 IgG1)의 Fc 부위를 자연살해세포나 세포독성 T 세포와 같은 세포독성세포가 인식하여 비정상 세포의 세포자멸사(apoptosis)를 유발할 수 있다.
- 과립구의 탈과립(degranulation of granulocyte) - IgE 클래스 항체 등은 과립구가 세포 안에 가지고 있는 과립 성분들(주로 병원체를 죽이기 위한 용해 효소 등)을 분비하게 하여 병원체를 살상할 수 있다.
5. 동형[편집]
포유류의 항체는 IgA, IgD, IgE, IgG, IgM 다섯 가지의 동형(isotype)으로 나뉜다. Ig는 immunoglobulin의 줄임말이고 A, D, E, G, M은 각각 중쇄에 해당하는 그리스 문자와 관련이 있다. IgA는 α 클래스, IgD는 δ 클래스, IgE는 ε 클래스, IgG는 γ 클래스, IgM은 μ 클래스의 중쇄를 가진다. 경쇄는 상술했듯 κ와 λ 두 종류의 쇄형이 존재한다. 이 중 단량체(monomer)로만 존재하는 항체는 IgD, IgE, IgG이며, IgA나 IgM 항체는 체내에서 중합체(polymeric)로 존재할 수 있다.
어떤 동형의 항체이든 중화(neutralization) 작용을 일으켜 침입한 병원체의 독성을 약화시킬 수 있다. 포유류의 항체 중에서도 IgE는 알러지(Allergy)와 관련이 있다. 알러지에는 타입이 여러 개가 있는데, IgE는 그중에서도 타입 1인 '항원과 접촉하면 즉시 반응이 오는' 알러지와 관련이 있다. IgA는 점막이나 침, 눈물, 모유 등에 있고 IgG와 IgM은 내재면역(Innate Immunity)[5]과 관련이 있다. IgD는 항원에 노출되지 않은 B세포의 항원 수용체로 작용한다.
5.1. IgA[편집]
 자세한 내용은 면역글로불린 A 문서를 참고하십시오.
자세한 내용은 면역글로불린 A 문서를 참고하십시오. 면역글로불린 A(Immunoglobulin A, IgA)의 가장 중요한 기능은 위장이나 호흡기, 배설계[6]에서의 장벽 면역과 체액에서의 분비형 항체 기능이다. IgA는 상피세포에서 발현되는 Fc 수용체의 일종인 polymeric Ig receptor(polyIgR)에 의해 혈류 속에서 점막 조직이 존재하는 기관들의 내강 안으로 세포통과(transcytosis)하여 기능한다. 혈중에서는 주로 단량체로, 분비형 항체는 주로 이량체(dimer) 형태를 하고 있다.
5.2. IgD[편집]
 자세한 내용은 면역글로불린 D 문서를 참고하십시오.
자세한 내용은 면역글로불린 D 문서를 참고하십시오. 면역글로불린 D(Immunoglobulin D, IgD)는 IgM과 함께 성숙 B 세포(mature B cell)의 세포막 표면에 부착된 막 수용체로 발견되는 면역글로불린 동형이나, 생물학적 기능이 다른 동형의 면역글로불린들보다 명확하게 밝혀지지 않았다.
5.3. IgE[편집]
 자세한 내용은 면역글로불린 E 문서를 참고하십시오.
자세한 내용은 면역글로불린 E 문서를 참고하십시오. 면역글로불린 E(Immunoglobulin E, IgE)는 다른 동형들보다 혈중 농도가 낮으며, 비만세포(mast cell)와 호산구(eosinophil), 호염구(basophil) 등의 백혈구들이 탈과립(degranulation)하도록 유도하여 병원체(특히 기생충이나 원생동물 등)를 죽이도록 하는 과립 성분을 방출시킨다. 또한, IgE는 알레르기나 천식에 관여한다는 사실이 널리 알려져 있다.
5.4. IgG[편집]
 자세한 내용은 면역글로불린 G 문서를 참고하십시오.
자세한 내용은 면역글로불린 G 문서를 참고하십시오. 면역글로불린 G(Immunoglobulin G, IgG)는 동형들 중 가장 혈청에서의 농도가 높고, 혈청내 반감기가 가장 길어 잘 줄어들지 않는 동형의 면역글로불린이다. 4개의 하위 클래스가 존재한다. 매크로파지의 Fc 수용체에 결합하여 옵소닌화를 돕거나, 일부 하위 클래스 IgG들은 보체의 활성화나 자연살해세포(NK cell)의 항체의존성 세포매개독성(antibody-dependent cell-mediated cytotoxicity) 등에 작용한다. 친화력 성숙(affinity maturation)을 거쳐 선별된 B 세포가 생산하기 때문에 항원 친화력이 뛰어나며, 일차면역반응에서 IgM이 먼저 다량 생산된 이후에 같은 병원체 침입 시에 보통 많이 생산된다.
5.5. IgM[편집]
 자세한 내용은 면역글로불린 M 문서를 참고하십시오.
자세한 내용은 면역글로불린 M 문서를 참고하십시오. 면역글로불린 M(Immunoglobulin M, IgM)은 일차면역반응 시에 가장 먼저 만들어지는 항체 동형이다. 친화력 성숙(affinity maturation) 과정을 거치지 않은 B 세포가 생산하기 때문에 하나하나의 항원 결합 부위와 항원과의 결합력은 비교적 약하지만, 다량체로 존재하기 때문에 부족한 결합력을 다수의 항원 결합 부위를 통해 보완할 수 있다. '자연 항체(natural antibody)'라고 불리기도 하는데, 이는 병원체에 노출되지 않고도 내장이나 일부 점막 조직에서 B-1 B 세포(B-1 B cell)가 이 IgM을 생산하기 때문이다.
5.6. 그 외[편집]
포유류의 항체 동형은 위 5가지이지만, 다른 생물 종들에서는 IgY나 IgW와 같은 다른 항체 동형들이 발견된다.
6. 항체 형성[편집]
보통 태어난 순간에는 모체에서 유래된 항체는 존재하지만 특정한 항원을 인식하지는 못한다. 성장하면서 각종 박테리아와 같은 미생물이나 바이러스 등에 노출되거나 병에 걸리거나 하면서 특정한 항원을 인식하게 된다. 인식하는 법은, B세포가 분화할 때 항체의 Y자 양쪽 끝부분의 항원결합부를 구성하는 단백질의 유전자 서열이 랜덤하게 바뀌게 되면서 운이 좋게(?) 특정 항원을 인식하게 된다. 면역세포의 성숙 참조.
하나의 B세포에서 분비된 항체들은 본래 항원의 특정한 하나의 부위[7]에만 특이적으로 결합할 수 있다. 항원이 침투된 개체는 항체 생산을 위한 B세포를 수 없이 찍어내어 가동하고, 이 여러 B세포들은 각자의 항체들을 분비하여 혈중의 항원은 여러 항체에[8] 결합당하게 된다. 이때 이 개체의 혈액을 뽑아 해당 항원에 대한 특이 반응성을 이용해 항체들을 혈액으로부터 분리하여 모으면, 다중클론항체[9]가 된다. 이와 구분하여 단일클론항체(Monoclonal Antibody)라는 것이 있는데, 특정 항원이 투여된 쥐[10]의 췌장 혹은 혈장 등으로부터 B세포를 분리하고 암세포와 퓨전을 유도하여 사멸하지 않는 융합세포를 만든 다음[11], 유효한 스크리닝 방법으로 효율성 좋은 항체[12]를 제조하는 융합세포를 선별하고 배양하면서 특정 epitope에만 결합할 수 있는 단일 종류의 항체를 분리 및 수집하는 형태로 제작된다.[13]
7. 응용[편집]
특정 물질에 특이적으로 결합하는 항체의 특성을 응용하여 면역 염색법이나 웨스턴 블로팅[14] 등에 활용 중이며, 이게 없으면 실험실이 안 돌아갈 정도로 중요한 녀석 중 하나. 가격은 백금보다도 비싸서, 실험실에서 웨스턴 블로팅을 할 때 쓰는 1차 항체는 버리지 않고 사용했다가 다시 모은다. 비싼 이유는 저걸 만드는 과정이 아스트랄하기 때문인데, 쥐, 토끼, 염소등의 동물에다 항원을 주사하고 기다렸다 피를 막 뽑아내서 그걸 항원을 이용해 정제해서 만들기 때문이다.[15] 아직까지는 제대로 된 항체를 만드는 방법이 실제 동물을 이용하는 수밖에 없기 때문.
사실, 항체의 특이 반응성을 응용한 가장 큰 사업 영역은 체외 진단 영역이다. 2012년 기준 체외진단(IVD, In vitro diagnosis) 전체 글로벌 시장의약 36%가 면역진단 방식으로, 2012년 면역체외진단 글로벌 시장 규모는 233억[16] 달러 수준이다. 면역진단은 면역체[17]의 특이 반응성을 이용하기 때문에 당연히 원료로 항체가 이용되며, 항체는 보통 제조원가의 가장 큰 부분을 항체가 차지한다.
이 영상은 의외로 《네이처》 지에서 운영하는 유튜브 채널에 올라온 것이다.
항체는 병원체뿐 아니라 정자 등 외부에서의 유입에 대한 면역체계의 작용으로 생성된다. 처녀를 감별할 수 있다는 낭설인 항정자 항체 검사는 여기에서 유래된 것.
현재 유방암이나 백혈병 등 암 치료나, 염증 질환 치료에도 항체가 사용[18]관련되고 있는데, 당연히 단일클론항체들이다.[19]
형광 현미경(Fluorescence Microscopy)에 사용하는 형광물질도 면역 반응을 이용해 시료에 태깅하는 경우가 많다 [20].
 이 문서의 내용 중 전체 또는 일부는 2023-12-25 16:52:52에 나무위키 항체 문서에서 가져왔습니다.
이 문서의 내용 중 전체 또는 일부는 2023-12-25 16:52:52에 나무위키 항체 문서에서 가져왔습니다.[1] 항체가 항원에 달라 붙을 수 있는 원동력은 분산력이므로, 항체와 항원 간의 접촉 면적이 최대화되어야지만 결합이 가능하다. 즉, 항체와 항원 표면의 입체 구조가 완전히, 혹은 거의 동일한 형태여야 하며, 결국 한 종류의 항체가 결합 가능한 항원의 종류는 극히 일부로 제한되게 된다. 이를 항원 특이적 결합이라 한다.[2] 파파야, 키위 등에 있는 단백질 분해 효소.[3] 정확히 파파인 실험 결과 형성된 절편들이 합쳐진 것과 똑같지는 않으므로 '이 붙는다. 파파인 결과 형성된 Fab 절편은 경첩 부위를 포함하지 않으나 펩신 실험 결과 형성된 F(ab')2 절편은 경첩 부위를 포함한다.[4] 고전경로(classical pathway), 렉틴경로(lectin pathway), 대체경로(alternative pathway)[5] 또는 자연면역.[6] 즉, 외부 공간과 맞닿아 열려 있는 조직들.[7] 이렇게 항체가 특이적으로 결합하는 항원의 특정 부위를 항원결정기(epitope)라고 한다.[8] 온갖 곳이 epitope가 되어[9] 여러 개의 B세포로부터 분비된 항체가 모여있기 때문[10] 투여된 특정 항원에 대해 체내에서 면역반응이 유도된 개체[11] B세포는 시간이 지나면 자기사멸을 하는 세포이기 때문에, 사멸을 모르는 암세포와 융합시켜 치트키를 쓰는 것이다.[12] 항원-항체 결합력이 강하고, 비특이 결합성이 낮은 항체[13] 이 방법은 1984년 노벨 생리학상을 받은 기법이다.[14] Western blotting. 보통 특정 단백질 검출을 위한 전기영동 기반의 실험기법으로 항체를 사용하기 때문에 immuno-blotting이라고도 한다. 참고로, 전기영동 기반의 실험기법 중 DNA 검출을 위한 기법은 서던 블로팅(southern blotting)이며, RNA 검출을 위한 기법은 노던 블로팅(northern blotting)이며, 이 경우 보통 방사선표지된 핵산 프로브를 응용한다.[15] 이 기술은 다중클론항체(polyclonal antibody)를 제작하는 방법이다.[16] 한화로 약 25조 원 수준[17] 면역체를 항체라고 할 수는 없지만, 거의 대부분 항체를 사용한다.[18] 보통 해당 질병의 기전과 관련된 특정 단백질에 항체를 결합시켜 기능을 상실 시키는 원리이다.[19] ~맙(~mab)하고 끝나는 신약들이 단일클론항체 형태의 약물들이다. 맙은 "M"onoclonal "A"nti"B"ody의 약자[20] 물론 비면역 형광반응을 이용하기도 하지만 면역 형광에 비하면 비교적 드물다.