G 단백질 결합 수용체
덤프버전 :
1. 개요[편집]
G protein-coupled receptor. 줄여서 GPCR이라고 부른다. 한국말로 굳이 번역하자면 G 단백질 결합 수용체 또는 G 단백질 연결 수용체. 그러나 한국말로 불리는 경우는 별로 없다. 막을 관통하는 7개의 도메인이 있는 7TM(TransMembrane) 수용체로, 세포 바깥쪽에 N말단이 리간드를 인식하고, 세포 안쪽의 C말단이 신호를 전달한다. 이해가 안 된다면, 가느다란 실이 막을 지그재그로 7번 통과한 모습을 상상해보자. 호르몬, 지방산, 단백질, 신경전달물질 등이 신호가 되는 리간드다.
생체 내 신호전달에 매우 많이 쓰이는 수용체 종류로, 적어도 800개 이상의 유전자가 GPCR에 대한 정보를 담고 있다고 한다.[1] 그렇기에 수많은 생체 활동에 사용되는 아주 중요한 녀석들이다. 알려진 약품들의 절반 정도가 GPCR을 타겟팅한다고 하니… 참고로 GPCR의 구조 및 작동 원리를 밝혀낸 브라이언 코빌카는 2012년 노벨상을 수상하였다. 대표적인 기능은 다음과 같다.
- 빛과 화학물질 같은 감각 수용체 자극을 감지해 신호를 전달. 시각, 촉각, 후각 거의모든 감각에 GPCR이 관여한다. 예를 들어 우리가 빛을 인식하게 하는 로돕신이 바로 GPCR이다!
- 특정 자극을 수용해 감정이나 행동을 조절한다. 예를들어 행복을 느끼게 해준다는 세로토닌을 감지한다.
- 사이토카인(cytokine)을 인식해 면역계를 활성화시킨다. 예를 들어 호중구는 CXCL8을 인식해 손상 부위로 이동한다.
- 그 외 호르몬과 신경전달물질을 감지한다. 이는 항상성 조절에 관여하며, 성장에도 관여해 암을 일으키기도 한다는 뜻이다.
2. 매커니즘[편집]
2.1. G protein[편집]
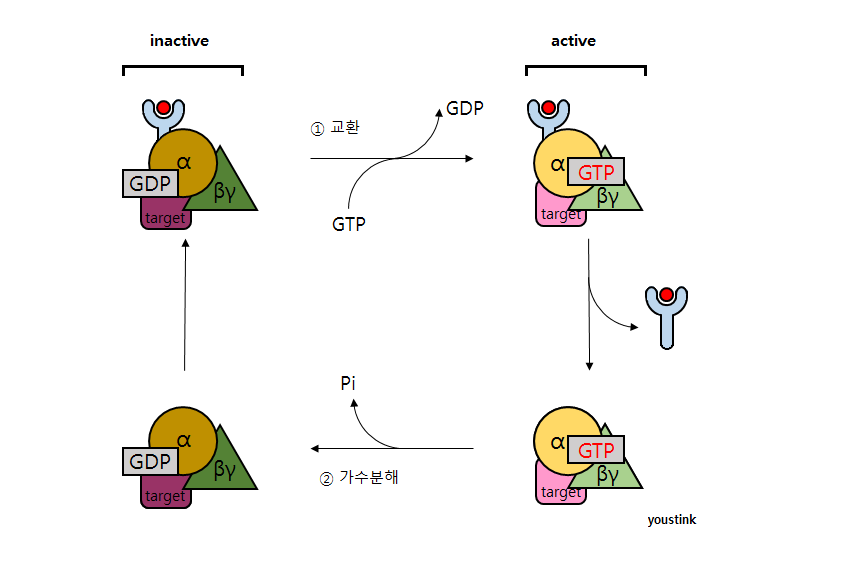
GPCR은 그 이름답게 G 단백질을 신호전달에 사용한다. G 단백질은 α, β, γ 총 세 개의 서브유닛으로 구성되어 있고, α 서브유닛에는 GDP가 결합해있다[2][3] G 단백질에 대한 자세한 정보는 G 단백질 문서를 참고하기를 바란다.
GPCR이 자극받으면 G 단백질이 활성화된다. G 단백질은 GPCR과 따로 떨어져있는 것으로 생각되나 최근에는 비활성 상태의 GPCR과 미리 복합체를 이루고 있다는 연구 결과도 나오고 있다.[4][5] 이 모델의 경우는 신호 전달이 더 빠르고, G 단백질을 선택적으로 고를 수 있다는 장점이 있다.[6] 어쨌든 G 단백질의 α 서브유닛의 구조가 바뀌면서 GDP가 GTP로 교체되면 β, γ 서브유닛도 활성화되고, 이렇게 활성화 된 G 단백질은 GPCR에서 떨어져 다음 목표 단백질로 이동한다. 이후로는 여느 신호전달 경로와 마찬가지로 여러 단백질들의 연쇄반응을 통해 최종적인 반응을 이끌어내게 된다. GPCR은 리간드가 붙어 있는 동안은 계속 활성화 상태를 유지하고, 이 상태에서 G 단백질들과 일시적으로만 상호작용하기 때문에[7][8][9], 여러 G 단백질들을 만나서 활성화시킬 수 있다.[10]
또한 G 단백질의 α 서브유닛과 βγ 복합체가 분리되어 각자 따로 행동한다고 보통 알려져있으나[11], 아직 확실하게 밝혀지진 않았다. 다만 α 서브유닛이 타겟 단백질과 결합하는 부분이 βγ 복합체와 결합하는 부위와 겹치기 때문에 분리될 가능성이 높다[12].
2.1.1. α 서브유닛[편집]
α 서브유닛은 대략 두 가지 경로를 이용해 막단백질을 활성화시킨다..
2.1.1.1. cAMP 경로[편집]
cAMP는 Adenylyl cyclase라는 효소에 의해 ATP가 변형된 분자다. 이 경로에서 활성화된 α 서브유닛이 막에 있는 adenylyl cyclase를 활성화시킨다. 곧 이 효소에 의해 여러 ATP가 cAMP로 변환되며, cAMP는 PKA(protein kinase[13] A)를 활성화시킨다. PKA는 또 다른 효소를 인산화 한다. 예를 들면 아드레날린 수용체에서 phosphorylase kinase를 인산화한다. PKA는 또한 CREB 같은 전사 인자를 인산화해 전사를 촉진시키도 하는데, 이는 전자에 비해 느린 작용이다.
2.1.1.2. 이노시톨 인지질(inositol phospholipid) 경로[편집]
PIP2은 막에 붙어있는 분자로, PI(phosphatidylinositol)가 PI 인산화효소[14], PIP 인산화효소[15][16]에 의해 차례대로 인산화된 결과물이다. α 서브유닛이 phospholipase C(PLC)를 활성화 시키면 PIP2가 DAG[17]와 IP3[18]으로 가수분해된다. DAG는 막에 계속 붙어있고 IP3은 세포질 내로 확산되다가 소포체의 칼슘 채널에 결합한다. 이로 인해 칼슘 이온이 세포질 내부로 확산되고, 이 칼슘과 함께 DAG가 PKC(protein kinase C)를 활성화시키게 된다[19]. 활성화된 PKC는 다음 신호 경로를 따라가게된다.
2.1.2. βγ 복합체[편집]
βγ 복합체 또한 신호 전달에 관여한다. 예를 들어 심장 근육에 있는 아세틸콜린 수용체의 K+ 이온 채널을 βγ 복합체가 열어서, 심장근육의 흥분기능을 낮추기도 한다.
2.2. GPCR 경로의 비활성화(desensitization)[편집]
활성화 상태의 GPCR은 GPCR 인산화효소를 활성화 시키게 되는데, 이는 곧 GPCR의 인산화로 이어지게 된다. 어레스틴(arrestin)이라는 단백질은 GPCR의 인산화된 부위를 인식해 GPCR과 G 단백질의 상호작용을 막고, 내포작용(endocytosis)을 유도한다.[20][21]
G 단백질의 α 서브유닛도 스스로 비활성화된다. 활성화된 α 서브유닛은 타겟 단백질에 붙어 있는 동안만 그 단백질을 활성화시키는데, α 서브유닛의 활성을 유지시키는 GTP는 수초내로 GDP로 가수분해되어 α 서브유닛은 떨어져나오게 된다. 이 α 서브유닛은 다시 βγ 복합체와 결합해 비활성화 상태의 G 단백질을 만든다. 다만 이것도 확실하진 않다. G 단백질과 타겟 단백질이 계속 붙어있으나 순수 GTP/GDP 차이에 의해 활성상태가 결정된다고 보는 경우도 있기 때문이다.
3. G 단백질과 독립적인 반응[편집]
이름과 어울리지 않게, 항상 G 단백질과 엮이는 것은 아니다. GPCR은 beta-arrestin이라는 단백질과도 연관되어 있는데 beta-arrestin은 GPCR로 부터 생성되는 alpha signalling을 탈감작 시킬 뿐 아니라 그 자체로도 MAPK, PI3K, AKT등을 활성화 시키기도 한다. 최근 연구에서는 biased ligand라는 개념이 등장했는데, GPCR에 수용체를 부착했을때 보통의 agonist는 G단백질과 beta-arrestin 모두를 활성화 시키지만, biased ligand는 G단백질 혹은 beta-arrestin 둘중 하나만 선택적으로 활성화 시켜 원하는 생리학적 활성을 보일 수 있다.[22]
4. 분류[편집]
Rhodopsin, Secretin, Adhesion, Glutamate, Frizzled, 기타 등으로 분류한다.
5. 관련 문서[편집]
6. 참고 자료[편집]
- http://gpcrdb.org/ – GPCR에 대한 데이터베이스를 저장하는 사이트이다.
 이 문서의 내용 중 전체 또는 일부는 2023-10-26 03:26:07에 나무위키 G 단백질 결합 수용체 문서에서 가져왔습니다.
이 문서의 내용 중 전체 또는 일부는 2023-10-26 03:26:07에 나무위키 G 단백질 결합 수용체 문서에서 가져왔습니다.[1] Bjarnadóttir TK, Gloriam DE, Hellstrand SH, Kristiansson H, Fredriksson R, Schiöth HB (September 2006). "Comprehensive repertoire and phylogenetic analysis of the G protein-coupled receptors in human and mouse". Genomics 88 (3): 263–73.[2] Wall MA, Coleman DE, Lee E, et al. The structure of the G protein heterotrimer Gi α1β1γ2. Cell. 1995;83:1047–1058. [3] 단 비활성 상태일 때 한정.[4] Hu J., Wang Y., Zhang X., Lloyd J.R., Li J.H., Karpiak J., Costanzi S., Wess J. Structural basis of G proteincoupled receptor-G protein interactions. Nat. Chem. Biol. (2010);6:541–548. doi: 10.1038/nchembio.385.[5] Qin K., Dong C., Wu G., Lambert N.A. Inactivestate preassembly of G(q)-coupled receptors and G(q) heterotrimers. Nat. Chem. Biol. (2011);7:740–747. doi: 10.1038/nchembio.642.[6] Challiss R.A., Wess J. Receptors: GPCR-G protein preassembly? Nat. Chem. Biol. (2011);7:657–658. doi: 10.1038/nchembio.665.[7] Levitzki A. From epinephrine to cyclic AMP. Science. 1988;241:800–806.[8] Gilman AG. G proteins and dual control of adenylate cyclase. Cell. 1984;36:577–579.[9] Arad H, Rosenbusch JP, Levitzki A. Stimulatory GTP regulatory unit Ns and the catalytic unit of adenylate cyclase are tightly associated: mechanistic consequences. Proc Natl Acad Sci U S A. 1984;81:6579–6583.[10] 여기에서 신호가 첫번째로 증폭된다.[11] Gilman AG. G proteins and dual control of adenylate cyclase. Cell. 1984;36:577–579.[12] Cabrera-Vera, T.M. et al. Insights into G protein structure, function, and regulation.Endocr. Rev. 24, 765–781 (2003).[13] 인산화효소[14] PIP, 즉 PI 4-phosphate를 생성[15] PIP를 PIP2(PI 4,5-biphosphate)로 만듬[16] 각 효소는 ATP를 소모한다.[17] diacylglycerol, 디아실글리세롤[18] 이노시톨 1,4,5 triphosphate[19] 정확히는 칼슘 농도가 올라가면서 활성화시키기 쉬워진 거다.[20] Laporte SA, Oakley RH, Holt JA, Barak LS, Caron MG (Jul 2000). "The interaction of beta-arrestin with the AP-2 adaptor is required for the clustering of beta 2-adrenergic receptor into clathrin-coated pits". The Journal of Biological Chemistry 275 (30): 23120–6. doi:10.1074/jbc.M002581200. PMID 10770944.[21] Laporte SA, Oakley RH, Zhang J, Holt JA, Ferguson SS, Caron MG, Barak LS (Mar 1999). "The beta2-adrenergic receptor/betaarrestin complex recruits the clathrin adaptor AP-2 during endocytosis". Proceedings of the National Academy of Sciences of the United States of America 96 (7): 3712–7. doi:10.1073/pnas.96.7.3712. PMC 22359. PMID 10097102.[22] Kobilka BK (2011) Structural insights into adrenergic receptor function and pharmacology. Trends Pharmacol Sci 32(4):213–218